| Nome comune: | Lampreda padana |
|---|---|
| Nome Direttiva Habitat: | Lethenteron zanandreai (Vladykov, 1955) |
| Codice Specie: | 1097 |

La lampreda padana, Lampetra zanandreai
Massimo Lorenzoni, 2014-05-26
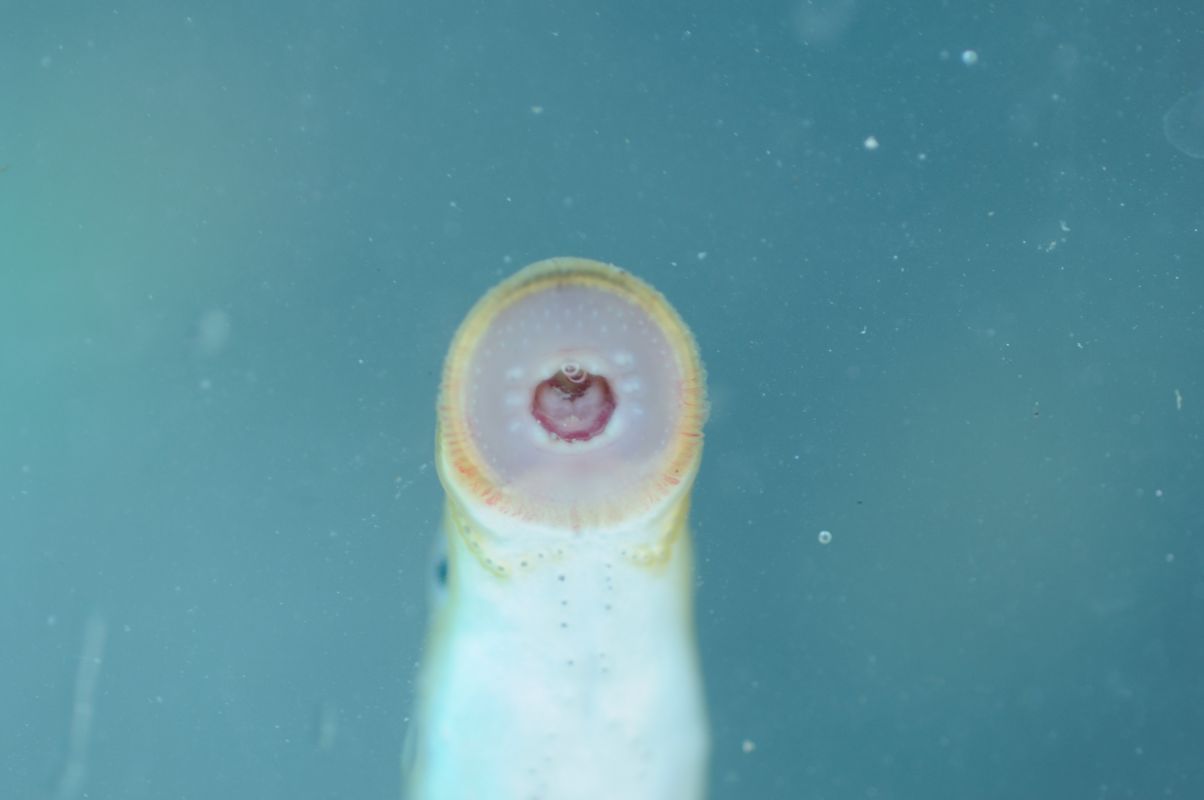
Particolare della bocca di lampreda padana
Massimo Lorenzoni, 2014-05-26
Le lamprede, a differenza dei pesci, sono prive di mascelle e pinne pari. Il corpo è cilindrico e affusolato, e raggiunge una lunghezza massimo di 17 cm. La pelle ha una colorazione bluastra, con sfumature giallastre sui fianchi. Presenta 7 fessure branchiali per lato. Le larve alla nascita e nei primi anni di vita sono cieche e prive di denti. Dopo 4-5 anni vanno incontro a metamorfosi nella forma adulta: compaiono gli occhi e la tipica bocca a forma circolare provvista di dentatura. La pinna caudale è saldata con la seconda dorsale, più estesa ventralmente che dorsalmente.
La lampreda padana, a differenza di molte altre lamprede, non è un parassita degli altri pesci e trascorre tutta la sua vita in acque dolci, non migrando mai verso il mare. La fase larvale si svolge nei settori vallivi, su fondali a corrente moderata e substrato molle, dove l'ammocete resta infossato e si nutre per filtrazione. Dopo la metamorfosi si assiste ad una rapida maturazione delle gonadi e alla degenerazione dell’intestino. A secondo della latitudine, la riproduzione si svolge nel periodo da marzo a tutto giugno ed è preceduta da piccole migrazioni degli adulti verso corsi d'acqua con acque pure, ben ossigenate e substrato ghiaioso. Dopo la frega gli adulti muoiono. Alla schiusa, le larve sono trasportate passivamente dalla corrente fino a zone adatte al loro sviluppo.
La specie è endemica del distretto padano-veneto. La gran parte del suo areale ricade in Italia: è presente nel versante alpino del bacino del Po, in Veneto, in Friuli-Venezia Giulia e, con popolazioni isolate nell'Appennino marchigiano. È stata segnalata anche nel versante adriatico della Slovenia e in Dalmazia (a sud fino al bacino del Fiume Neretva). In Umbra è presente un’unica popolazione isolata nel nella porzione della regione che fa parte del versante Adriatico, al confine con le Marche.
| 3° Report ex-Art. 17 | IUCN globale | IUCN Italia | convenzione di Berna | SPEC | CITES | |
|---|---|---|---|---|---|---|
| RBC | RBM | |||||
| ↓ | LC-Least Concern | VU-Vulnerabile | Allegato III-Specie di fauna protette | - | - | |
Pressioni IUCN: H01- Inquinamento delle acque superficiali (limniche e terrestri); J02.02.01- dragaggio/rimozione di sedimenti limnici; J02.05.02- modifica della struttura dei corsi d'acqua interni; J02.06- Prelievo di acque superficiali; J02.07- Prelievo di acque sotterranee (drenaggio, abbassamento della falda); J03.01- Riduzione o predita di specifiche caratteristiche di habitat; M01.02- Siccità e diminuzione delle precipitazioni
Minacce IUCN: H01- Inquinamento delle acque superficiali (limniche e terrestri); J02.02.01- dragaggio/rimozione di sedimenti limnici; J02.05.02- modifica della struttura dei corsi d'acqua interni; J02.06- Prelievo di acque superficiali; J02.07- Prelievo di acque sotterranee (drenaggio, abbassamento della falda); J03.01- Riduzione o predita di specifiche caratteristiche di habitat; M01.02- Siccità e diminuzione delle precipitazioni
Indicatori per il monitoraggio
[Fonte: Linee guida dei pesci e agnati - PROGETTO SUN LIFE]
TECNICHE DI MONITORAGGIO PROPOSTE:
sito: la selezione dei siti dovrebbe consentire di rappresentare le diverse tipologie ambientali e le pressioni antropiche rilevabili. Il numero di stazioni di campionamento per ogni corso d’acqua deve essere scelto in base alla lunghezza del tratto presente all’interno della ZSC e all’uniformità ambientale che lo caratterizza. Sarà necessario individuare almeno una stazione di campionamento ogni 20 km di corso d’acqua e una ogni significativo cambiamento di pendenza media dell’alveo, tale da far modificare la zonazione ittica teorica e la comunità ittica potenziale di riferimento
periodo di campionamento: tarda estate-inizio autunno
tecniche di campionamento: elettrostorditore per gli ambienti lotici guadabili, elettrostorditore di potenza elettrica maggiore di 2,5 kw, collocabile su un’imbarcazione, per gli ambienti lotici non guadabili.
metodo di campionamento: campionamento di tipo quantitativo per gli ambienti lotici guadabili (metodo delle passate successive), semiquantitativo per gli ambienti lotici non guadabili e lentici.
condizioni per il campionamento: al fine di adottare modalità standardizzate e replicabili, il campionamento dovrà essere evitato nelle seguenti condizioni: in caso di portate elevate; in caso di elevata torbidità dell’acqua; in caso di pioggia continua; in caso di vento intenso; inferiori ai 4°C o superiori ai 20°C. Il campionamento deve essere condotto in orari e condizioni di copertura del cielo tali da consentire un’adeguata illuminazione ai fini dell’individuazione degli esemplari da catturare.
frequenza: cadenza biennale.
operatori: la squadra che opera in alveo dovrà essere costituita da un numero adeguato di operatori in funzione della dimensione del corpo idrico campionato e delle caratteristiche della comunità attesa. Nella maggior parte delle situazioni si reputa idonea una squadra costituita da almeno 3 o 4 operatori (1 deputato all’uso dell’elettrostorditore, 1 munito di guadino, 1 o 2 adibiti al trasporto dei pesci alle vasche di stabulazione, al periodico controllo delle condizioni degli stessi e alla registrazione dei dati ambientali).
Analisi degli individui catturati:
Lunghezza totale (in mm)
Peso (rilevato alla precisione minima di 1 grammo).
Passata in cui l’individuo è stato catturato.
Eventuale presenza di macroscopiche anomalie o patologie esterne (annotare solo presenza o assenza e annotare il tipo di anomalia).
Il rilievo delle foto dei singoli individui è facoltativo.
Precauzioni per l’incolumità dei pesci
L’elettrostorditore deve essere utilizzato col dosaggio minimo efficace; non prolungare eccessivamente l’attività di elettropesca in uno spazio limitato.
Interrompere il campionamento, o modificare le impostazioni dell’elettrostorditore, qualora si rilevino danni troppo frequenti o segni di stress eccessivo sui pesci catturati.
Mantenere nei secchi di raccolta un numero limitato di pesci e provvedere al ricambio periodico di un’aliquota di acqua.
Il rilevamento dei parametri morfometrici deve essere effettuato manipolando i pesci con i guanti per evitare l’asportazione del muco e lo shock termico.
Dopo i rilevamenti morfometrici i pesci devono essere stabulati in vasche areate e monitorati per rilevare eventuali stress e danni prima di essere rilasciati.
I piccoli pesci, se possibile, dovrebbero essere sempre mantenuti separati dai soggetti di grandi dimensioni.
Indicatori:
Quantitativi
N individui: espresso come densità (numero di individui al metro quadro) o biomassa areale (standing crop, grammi al metro quadro).
Semi-quantitativi
Catture per unità di sforzo (CPUEs)
Qualitativi
Distribuzione delle Popolazioni: Censimento delle specie presenti con le metodologie di campionamento sopra indicate.
Struttura per età: Verifica della capacità di riproduzione, il reclutamento dei giovani e l’automantenimento. L’età può essere determinata mediante analisi della distribuzione di frequenza delle lunghezze.
Indici di condizione: stima dello stato di benessere dei pesci.
Per maggiori dettagli sulle procedure di campionamento negli ambienti fluviali si consiglia di fare riferimento al Protocollo di campionamento e analisi della fauna ittica dei sistemi lotici (APAT, 2007; ISPRA, 2014), mentre per gli ambienti lentici si può fare riferimento al “Protocollo di campionamento della fauna ittica nei laghi italiani” dell’ISPRA (Volta et al., 2014).
APAT, 2007. Protocollo di campionamento e analisi della fauna ittica dei sistemi lotici. In: “Metodi Biologici per le Acque. Parte I”. Manuali e Linee Guida, APAT, Roma, 31 pp.
Genovesi P., Angelini P., Bianchi E., Dupré E., Ercole S., Giacanelli V., Ronchi F., Stoch F.,2014. Specie e habitat di interesse comunitario in Italia: distribuzione, stato di conservazione e trend. ISPRA, Serie Rapporti, 194/2014
ISPRA, 2014. Protocollo di campionamento e analisi della fauna ittica dei sistemi lotici guadabili. Manuali e linee guida, ISPRA, Roma,111: 20 pp.
Stoch F., Genovesi P. (ed.), 2016. Manuali per il monitoraggio di specie e habitat di interesse comunitario (Direttiva 92/43/CEE) in Italia: specie animali. ISPRA, Serie Manuali e linee guida, 141/2016, 378 pp.
Volta P., Sala P., Campi B., Cerutti I., 2014. Protocollo di campionamento della fauna ittica nei laghi italiani. Report CNR ISE 02.14, 15 pp.
Zerunian S., 2004. Pesci delle acque interne d'Italia. Ministero dell’Ambiente – Istituto Nazionale Fauna Selvatica. In Quaderni di Conservazione della Natura 20, 257 pp.
Freyhof, J. 2006. Lampetra zanandreai. The IUCN Red List of Threatened Species 2006: e.T60798A12401347. http://dx.doi.org/10.2305/IUCN.UK.2006.RLTS.T60798A12401347.en. Downloaded on November 2015.
www.iucn.it
Massimo Lorenzoni, Laura Pompei
Specie potenzialmente presente nei seguenti habitat:
Specie presente nei seguenti siti:
Specie citata nei seguenti allegati:
All. II-Specie animali e vegetali d'interesse comunitario la cui conservazione richiede la designazione di zone speciali di conservazione